Más tarde se trasladó a Alemania, para ampliar estudios en Heidelberg, donde conoció a los químicos más destacados de la época. A su regreso a Rusia fue nombrado profesor del Instituto Tecnológico de San Petersburgo (1864) y profesor de la universidad (1867), cargo que se vería forzado a abandonar en 1890 por motivos políticos, si bien se le concedió la dirección de la Oficina de Pesos y Medidas (1893).
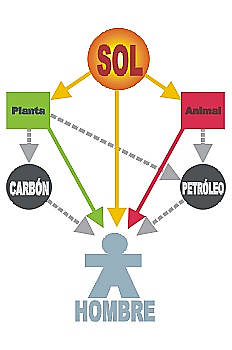
Entre sus trabajos destacan los estudios acerca de la expansión térmica de los líquidos, el descubrimiento del punto crítico, el estudio de las desviaciones de los gases reales respecto de lo enunciado en la ley de Boyle-Mariotte y una formulación más exacta de la ecuación de estado. En el campo práctico destacan sus grandes contribuciones a las industrias de la sosa y el petróleo de Rusia.
Con todo, su principal logro investigador fue el establecimiento del llamado sistema periódico de los elementos químicos, o tabla periódica, gracias al cual culminó una clasificación definitiva de los citados elementos (1869) y abrió el paso a los grandes avances experimentados por la química en el siglo XX.
Aunque su sistema de clasificación no era el primero que se basaba en propiedades de los elementos químicos, como su valencia, sí incorporaba notables mejoras, como la combinación de los pesos atómicos y las semejanzas entre elementos, o el hecho de reservar espacios en blanco correspondientes a elementos aún no descubiertos como el eka-aluminio o galio (descubierto por Boisbaudran, en 1875), el eka-boro o escandio (Nilson, 1879) y el eka-silicio o germanio (Winkler, 1886).
| modelos atómicos |
 |
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia.
Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles.
Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración. |
| Año | Científico | Descubrimientos experimentales | Modelo atómico |
| 1808 | 
John Dalton |
| Durante el s.XVIII y principios del XIX algunos científicos habían investigado distintos aspectos de las reacciones químicas, obteniendo las llamadasleyes clásicas de la Química. |
 |
|
| La imagen del átomo expuesta por Dalton en su teoría atómica, para explicar estas leyes, es la de minúsculas partículas esféricas, indivisibles e inmutables, |
| iguales entre sí en cada elemento químico. |  |
|
| 1897 | 
J.J. Thomson |
| Demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. |
 |
|
| De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. |
| (Modelo atómico de Thomson.) |  |
|
| 1911 | 
E. Rutherford |
| Demostró que los átomos no eran macizos, como se creía, sino que están vacíos en su mayor parte y en su centro hay un diminuto núcleo. |
 |
|
| Dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente. |
| (Modelo atómico de Rutherford.) |  |
|
| 1913 | 
Niels Bohr |
| Espectros atómicos discontinuos originados por la radiación emitida por los átomos excitados de los elementos en estado gaseoso. |
 |
|
| Propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos. |
| (Modelo atómico de Bohr.) |  |
|
|
 |
|
Átomos
Los átomos se clasifican de acuerdo al número de protones y neutrones que contenga su núcleo. El número de protones o número atómico determina su elemento químico, y el número de neutrones determina su isótopo. Un átomo con el mismo número de protones que de electrones es eléctricamente neutro. Si por el contrario posee un exceso de protones o de electrones, su carga neta es positiva o negativa, y se denomina ion.
El nombre «átomo» proviene del
latín «
atomum», y este del
griego «
ἄτομον», «sin partes»; también, se deriva de «a» (no) y «tomo» (divisible); no divisible.
1 El concepto de átomo como bloque básico e indivisible que compone la
materia del
universo fue postulado por la
escuela atomista en la
Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el
siglo XIX. Con el desarrollo de la
física nuclear en el
siglo XX se comprobó que el átomo puede subdividirse en
partículas más pequeñas.
2 3
Los átomos son objetos muy pequeños con masas igualmente minúsculas: su diámetro y masa son del orden de la billonésima parte de un
metro y cuatrillonésima parte de un
gramo. Solo pueden ser observados mediante instrumentos especiales tales como un
microscopio de efecto túnel. Más de un 99,94% de la masa del átomo está concentrada en su núcleo, en general repartida de manera aproximadamente equitativa entre protones y neutrones. El núcleo de un átomo puede ser inestable y sufrir una
transmutaciónmediante
desintegración radioactiva. Los electrones en la nube del átomo están repartidos en distintos niveles de energía u
orbitales, y determinan las propiedades químicas del mismo. Las transiciones entre los distintos niveles dan lugar a la emisión o absorción de
radiación electromagnética en forma de
fotones, y son la base de la
espectroscopia.
Isotopos
Los isótopos de un elemento tienen las mismas propiedades químicas pero difieren algo en sus propiedades físicas. Esta pequeña diferencia deriva de su distinta masa atómica. Así, mientras que la moléculas de agua ligera pesa 18 dalton, la molécula de agua pesada (contiene D en lugar de H) pesa 20 dalton. Este aumento afectará a su densidad, temperatura de ebullición, etc
Los isótopos del carbono son 116C (6 protones y cinco neutrones), 126C (6 protones y seis neutrones),136C (6 protones y siete neutrones) y 146C (6 protones y ocho neutrones)
Iones
Átomo o conjunto de átomos con carga eléctrica debida a la pérdida o ganancia de electrones.En la electrólisis, partícula que se dirige, cada una hacia un polo, como resultado de la descomposición del electrólito.
Ion: En química, se define al ion o ión, del griego ión (ἰών), participio presente de ienai "ir", de ahí "el que va", como una especie química, ya sea un átomo o una molécula, cargada eléctricamente. Esto se debe a que ha ganado o perdido electrones de su dotación, originalmente neutra, fenómeno que se conoce como ionización.
Cation: Un catión es un ion (sea átomo o molécula) con carga eléctrica positiva, esto es, con defecto de electrones. Los cationes se describen con un estado de oxidación positivo.
Anion: Un anión es un ion (sea átomo o molécula) con carga eléctrica negativa, esto es, con exceso de electrones. Los aniones se describen con un estado de oxidación negativo.